La chaleur, ça s’échange
Vous préparez un matin le sac à pique-nique.
Allez-vous mettre le soda réfrigéré et le café chaud dans le même sac isotherme ?
Non, bien sûr !
Pourquoi ? Que se passerait-il dans le sac isotherme ?
Essayons l’expérience suivante
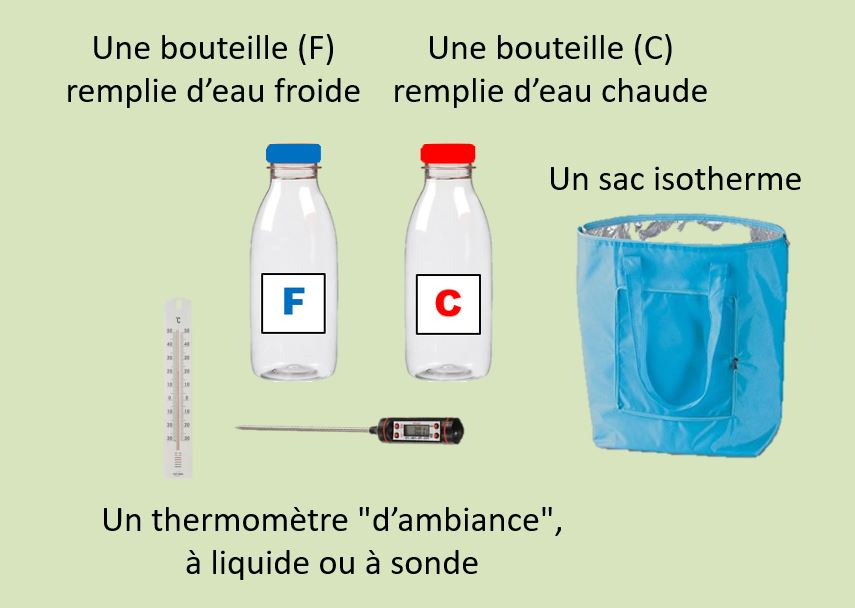
Relevez et notez la température de l’eau dans chaque bouteille ; placez-les dans le sac isotherme et attendez 3 heures. Comment pensez-vous que la température de chaque bouteille a évolué ?
Entrouvrez le sac, posez vos mains sur chacune des bouteilles avant de refermer le sac. Qu’avez-vous constaté ? Vos prévisions sont-elles vérifiées ?
La température de la bouteille F a augmenté.
D’habitude, comment faites-vous pour augmenter la température d’un liquide ?
Pour chauffer de l’eau, vous pouvez mettre la casserole d’eau sur un brûleur à gaz, sur une plaque chauffante électrique, sur un radiateur, au soleil…
Revenons à notre sac isotherme. D’où vient la chaleur qui a réchauffé l’eau de la bouteille F ? De la bouteille C, bien évidemment. Comment cela s’est-il manifesté ?
Maintenant, essayez de rédiger vous-même votre première Conclusion Locale Provisoire (CLP) :
Si vous attendez encore plus longtemps (au moins 5h), comment la température de chaque bouteille va-t-elle évoluer ? Jusqu’où ?
Vérifiez-le avec le thermomètre. Essayez votre deuxième Conclusion Locale Provisoire
Que se passe-t-il dans le sac isotherme ? Les deux bouteilles, à des températures différentes, échangent de la chaleur, la plus chaude donnant de la chaleur à celle qui est plus froide (voir votre 1ère expérience et la première CLP) : la température de la plus chaude diminue, la température de la plus froide augmente. Mais jusqu’où… ?
Un raisonnement par l’absurde nous donne la réponse : si un objet est plus chaud (ou plus froid), alors il va donner (ou prendre) de la chaleur à l’autre objet plus froid (ou plus chaud). Cet échange dure aussi longtemps qu’il est plus chaud (ou plus froid) que l’autre. À la fin, leur température est la même.
Et maintenant si au lieu de deux bouteilles on place ensemble plusieurs objets, chacun à une température différente dans un espace fermé – par exemple dans une pièce, porte et fenêtre closes, sans appareil de chauffage ou de réfrigération…
Essayer de généraliser le résultat précédent dans une troisième Conclusion Locale provisoire.
On a atteint ce que l’on appelle un “équilibre thermique”. Il n’y a plus de chaleur échangée et la température de chacun des objets et de l’air est identique.
Comment faire pour limiter les échanges de chaleur ?
Un sac isotherme est un récipient dont les parois ne laissent pas passer la chaleur… en théorie ! En pratique, on empêche du mieux possible les échanges de chaleur d”avoir lieu entre l’intérieur et l’extérieur. Malgré ça, au bout d’un certain temps, on constate que les températures des objets à l’intérieur et à l’extérieur du sac sont les mêmes. Finalement, elles sont égales à… la température ambiante de la pièce ou de l’environnement.
Avez-vous des idées pour faire encore plus barrage aux échanges de chaleur entre l’intérieur et l’extérieur du sac ? Inspirez-vous des techniques d’isolation dans le bâtiment, à la cuisine, dans l’habillement… Testez votre solution, avec du chaud puis du froid, vous serez étonné.
